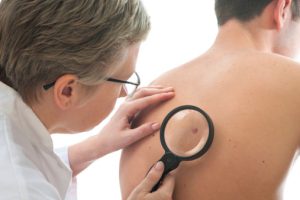
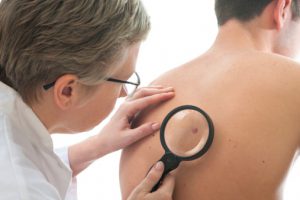
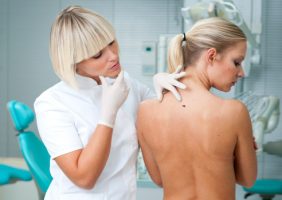
חברת התרופות רוש הודיעה היום כי מנהל המזון והתרופות של ארה”ב (FDA ) אישר את התרופה אריבדג’ (Erivedge vismodegib ), התרופה הראשונה למבוגרים הסובלים מקרצינומה מתקדמת של תאי הבסיס (BCC ), סוג סרטן העור השכיח ביותר. המחלה מתבטאת בנגעים המעוותים את המראה החיצוני ואף לאובדן התפקוד של האברים שנפגעו, והתרופה, הנלקחת פעם ביום דרך הפה, מסייעת בצמצום נגעים אלה.
התרופה מיועדת למבוגרים החולים בסרטן עור של תאי הבסיס בשלבים מתקדמים של המחלה, כגון מחלה שהתפשטה לחלקים אחרים של הגוף (שלב גרורתי), חזרה של המחלה לאחר ניתוח (מתקדם מקומי) וכד. אריבדג’ היא התרופה הראשונה שמאשר ה-FDA לחולים הסובלים מקרצינומה של תאי הבסיס בשלבים מתקדמים.
קרצינומה של תאי הבסיס נחשבת בדרך כלל לניתנת לריפוי כל עוד הסרטן מוגבל לאזור קטן של העור. אולם, במקרים נדירים, הנגעים עלולים להשחית את המראה החיצוני ולפלוש לרקמות סמוכות או אף להתפשט לחלקים אחרים של הגוף (גרורות). במקרים אלה של BCC מתקדם, לא ניתן לטפל במחלה באופן אפקטיבי בניתוח או הקרנה. BCC מתקדם מוביל לעתים קרובות להשחתת המראה החיצוני.
“אישור התרופה ע”י ה-FDA מספק טיפול חדש לאנשים עם קרצינומה של תאי הבסיס אשר עד היום לא היתה להם כל תרופה שתסייע לצמצם את הנגעים המשחיתים את המראה החיצוני או מאיימים על חייהם,” אמר ד”ר האל ברון, מנהל רפואי ראשי וראש פיתוח המוצרים הגלובליים. “אנו שמחים שבחצי השנה האחרונה הצלחנו לספק שתי תרופות חדשות לשני סוגים של סרטן עור מתקדם לאנשים אשר קודם לכן עמדו לרשותם אפשרויות טיפול מועטות, אם בכלל.”
היעילות של אריבדג’ בקרצינומה של תאי הבסיס
אישור ה-FDA לאריבדג’ מבוסס על תוצאות מחקר בינלאומי פאזה II שנערך במספר רב של מרכזים רפואיים. המחקר הראה שאריבדג’ הביאה להתכווצות הנגעים ב-43 אחוזים מהחולים עם BCC מתקדם מקומי וב-30% מהחולים עם BCC גרורתי. משך התגובה הממוצע היה 7.6 חודשים.
מקור: הודעת חברת רוש














השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!