הודעת פייזר
מנהל המזון והתרופות האמריקאי (FDA) הודיע הלילה כי הוא מאשר את התרופה פאלבוציקיליב (Palbociclib), ובשמה המסחרי Ibrance® לטיפול בסרטן שד גרורתי. התרופה שפותחה על ידי חברת התרופות פייזר אושרה במסגרת התכנית לאישור מואץ של ה-FDA . מסלול זה מזרז את הכנסתן לשוק של תרופות לטיפול במחלות חמורות או מסכנות חיים, שמחזיקות בפוטנציאל לענות על צרכים רפואיים שעד כה נותרו ללא מענה.
בהודעה שפרסם ה-FDA, ציין הארגון כי החליט להגדיר את התרופה בתור “טיפול פורץ דרך” מכיוון שהעדויות הקליניות מוכיחות כי התרופה עשויה להציע יתרון משמעותי על פני טיפולים אחרים הקיימים כיום. על פי ממצאי ניסוי שנערך בקרב 165 נשים בגיל המעבר הלוקות בסרטן שד גרורתי, הצליחה התרופה לבלום משמעותית את התקדמות המחלה. אצל נסייניות שקיבלו פאלבוציקיליב יחד עם לטרזול (Letrozole), המחלה נעצרה למשך 20.2 חודשים בהשוואה ל- 10.2 חודשים בלבד בקרב נסייניות שקיבלו לטרוזל בלבד.
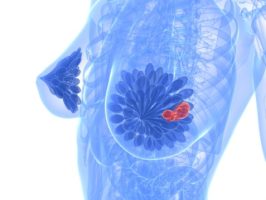
סרטן השדהינה המחלה הממארת השכיחה ביותר בישראל ובעולם המערבי בכלל. על פי ההערכות, כ- 4,500 נשים מאובחנות מדי שנה כחולות בסרטן השד בישראל, מתוכן יותר מ-20% צפויות לפתח סרטן שד גרורתי, סרטן שד מתקדם שהתפשט ושלח גרורות אל מעבר למקומו המקורי בשד.
פאלבוציקיליב, המשתייכת למשפחת התרופות הביולוגיות, מאטה את התפשטות התאים הסרטניים באמצעות עצירה סלקטיבית של שני אנזימים המעורבים בחלוקת תאים אלו: קינאזות תלויות–ציקליןמסוגים CDK4 ו- CDK6. פאלבוציקליב מיועדת לנשים בגיל המעבר עם סרטן שד גרורתי, חיובי לקולטן אסטרוגן (+ER), שלילי לקולטן לגורם גדילה אפידרמלי אנושי 2 (-HER2) אשר לא קיבלו טיפול מערכתי קודם למחלה. התרופה מיועדת לטיפול משולב עם לטרזול, טיפול הורמונאלי לסרטן השד המאושר גם כן על ידי ה-FDA.













השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!