מה ידוע עד כה?
איזה מידע המחקר הזה מוסיף?
- מחקר זה מדווח על תוצאות הבטיחות והיעילות ממחקר BE SURE וממחקר ההארכה בעל התווית הפתוחה BE BRIGHT על מנת להעריך את bimekizumab לטווח ארוך יותר.
- הממצאים של מחקר זה עוזרים לנו להבין האם התגובות הקליניות שנצפו במשך שנה עם bimekizumab נמשכות במשך שנתיים של טיפול, והאם השיפור בתגובות נשמר לאחר המעבר מ-adalimumab ל-bimekizumab.
- יתר על כן, מחקר זה מעריך את הבטיחות לטווח ארוך של bimekizumab.
רקע
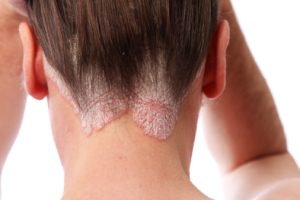
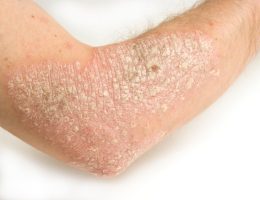
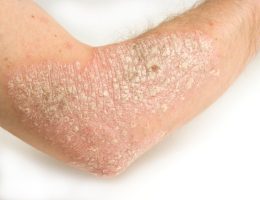
תוצאות מחקר ה-BE SURE לשנה אחת הדגימו את העליונות של bimekizumab בהשוואה ל-adalimumab מבחינת יעילות, ללא ממצאי בטיחות בלתי צפויים.
מטרות המחקר
מטרת מחקר זה הייתה לספק את נתוני היעילות והבטיחות במשך שנתיים של טיפול ב-bimekizumab בהשוואה ל-adalimumab בקרב חולים עם פסוריאזיס רובדית בינונית עד חמורה שהשתתפו במחקרי BE SURE ו-BE BRIGHT, מחקר ההארכה בעל התווית הפתוחה (OLE – (open label extension
שיטות
מחקר BE SURE, פאזה III, כפול סמיות ומבוקר אקראית במשך 56 שבועות, כשהמטופלים חולקו באקראי לקבוצות ביחס של 1:1:1 לקבלת 320 מ”ג bimekizumab כל 4 שבועות (Q4W), 320 מ”ג bimekizumab Q4W עד שבוע 16 ואז כל 8 שבועות (Q8W), או 40 מ”ג adalimumab כל שבועיים עד שבוע 24 ואז 320 מ”ג bimekizumab Q4W. לאחר השלמת BE SURE, המטופלים יכלו להיכנס למחקר,מחקר ההארכה בעל התווית הפתוחה שנקרא BE BRIGHT, עם אפשרות התאמות מינון בהתבסס על PASI (Psoriasis Area and Severity Index) התוצא העיקרי ב-BE BRIGHT היה שכיחות של תופעות לוואי שהופיעו עקב הטיפול (TEAEs); נתוני הבטיחות דווחו בתקופת המחקר עד שבוע 104. נתוני היעילות דווחו עבור אוכלוסיית החולים לפי גישת intention-to-treat עד שבוע 104 על ידי הקבוצה האקראית הראשונית, כאשר שיפור של לפחות 90% מה- PASI ההתחלתי (baseline) (PASI 90) ושיפור של 100% (PASI 100) היו התוצאים העיקריים במחקר.
תוצאות
מבין המטופלים שחולקו באקראי ל-bimekizumab, 158 הוקצו ל-Q4W ו-161 ל-Q4W/Q8W. בשבוע 104, PASI 90 הושג ב-91.2% ו-89.7%, ו-PASI 100 הושג ב-72.3% ו-68.1%, עבור Q4W ו-Q4W/Q8W, בהתאמה; בהשוואה לתוצאות בשבוע 16. בקרב 159 המטופלים שחולקו באקראי ל-adalimumab, התגובה לטיפול השתפרה במהירות ובאופן משמעותי לאחר ההחלפה ל- bimekizumab בשבוע 24; בשבוע 104, 96.9% ו-70.2% מהמטופלים השיגו PASI 90 ו-PASI 100 בהתאמה. במשך שבועות 24-104, שלושת ה-TEAEs הנפוצים ביותר בכל קבוצה שטופלה ב-bimekizumab היו nasopharyngitis, קנדידה אוראלית וזיהום בדרכי הנשימה העליונות. שיעורי ה-TEAEs החמורים היו נמוכים.
מסקנות
התגובות הקליניות שנצפו במהלך השבוע 16 של BE SURE בחולים ששובצו באקראי לטיפול ב-bimekizumab נמשכו לאורך 104 שבועות של טיפול, ללא קשר למינון האחזקה של Q4W או Q8W. שיעורי התגובה נשמרו גם במהלך שבוע 104 בחולים שעברו מ-adalimumab ל-bimekizumab בשבוע 24, והיו דומים לאלה שנצפו בקבוצות ה-bimekizumab. Bimekizumab היה נסבל היטב ללא ממצאים בטיחותיים נוספים.
למאמר המלא:
https://pubmed.ncbi.nlm.nih.gov/36689515/
בחסות חברת ניאופרם ישראל
1163-FEB-2023