• קוסנטיקס היא התרופה הביולוגית היחידה היכולה לשמש כקו הטיפול המערכתי (סיסטמי) הראשון לטיפול בפסוריאזיס, וכחלופה לטיפולים בעלי תופעות לוואי קשות1; כל שאר התרופות הביולוגיות מומלצות כקו טיפול שני24
• במחקר CLEAR משלב IIIb, הוכחה עליונותה של קוסנטיקס על סטלרה5
• אצל 70% או יותר מהמטופלים שקיבלו במחקרי שלב III 300 מ”ג קוסנטיקס התנקה העור לחלוטין (PASI 100) או כמעט לחלוטין (PASI 90) במהלך 16 שבועות הטיפול הראשונים6
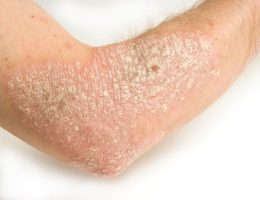
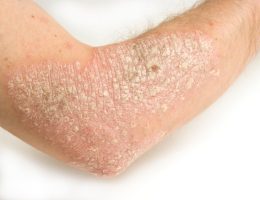
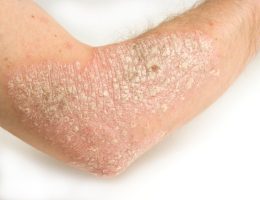
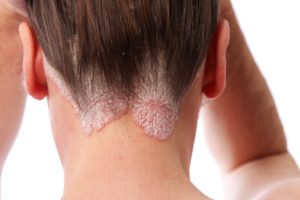
• עור נקי הוא יעד הטיפול האולטימטיבי לחולי פסוריאזיס; 50% מהחולי הפסוריאזיס אינם מרוצים מהטיפולים הנוכחיים שלהם710
נוברטיס הודיעה היום שרשות התרופות האירופית (EC) אישרה את קוסנטיקס (סקוקינומאב, ולשעבר AIN457) כקו ראשון בטיפול מערכתי* (סיסטמי), במבוגרים הסובלים מפסוריאזיס רובדית בדרגה בינונית עד חמורה המועמדים לטיפול מערכתי.
קוסנטיקס (במינון של 300 מ”ג) היא מעכב האינטרלוקין 17A (IL-17A) הראשון והיחיד שאושר באירופה, ואישור זה הוא ציון דרך חשוב בטיפול בפסוריאזיס, המאפשר למטופלים לקבל טיפול ביולוגי חדש וחשוב כקו הטיפול הראשון במחלתם. כיום, כל הטיפולים הביולוגיים נגד פסוריאזיס, לרבות נוגדי TNF וסטלרה** (אוסטקינומאב), מומלצים באירופה כקו טיפול המערכתי השני24.
“בעקבות החלטתה פורצת הדרך של רשות התרופות האירופית, עור נקי יכול להפוך למציאות עבור המטופלים החיים עם פסוריאזיס” אמר דייוויד אפשטיין (David Epstein), מנכ”ל נוברטיס פארמה. “כמעט חמישים אחוזים מן החולים אינם מרוצים מהטיפולים הנוכחיים שלהם, ובכללם גם הטיפולים הביולוגיים, עובדה המצביעה על צורך משמעותי של החולים שטרם ניתן לו מענה. קוסנטיקס, המומלצת בתור קו הטיפול המערכתי הראשון בפסוריאזיס תיתן לחולים סיכוי טוב יותר ליהנות מעור נקי או כמעט נקי”.
יעד הטיפול העיקרי בפסוריאזיס הוא השגת עור נקי ממחלה. אצל 70% או יותר מהמטופלים שקיבלו במחקרים קליניים 300 מ”ג קוסנטיקס התנקה העור לחלוטין (PASI 100) או כמעט לחלוטין (PASI 90) במהלך 16 שבועות הטיפול הראשונים, וחשוב לציין כי תוצאה זו נשמרה אצל מרבית המטופלים שהמשיכו בטיפול עד לשבוע 52 6. כמו כן הראו הנתונים מתוכנית הניסויים הקליניים על קוסנטיקס מתאם חיובי משמעותי בין עור נקי לחלוטין או כמעט לחלוטין לבין איכות החיים הקשורה לבריאות של חולי הפסוריאזיס11.
אישור רשות התרופות האירופית מצטרף לתוצאות שהתקבלו לאחרונה ממחקר CLEAR משלב IIIb, אשר הראו את עליונותה של קוסנטיקס על סטלרה** מבחינת ניקוי העור בעת הטיפול בחולי פסוריאזיס רובדית בדרגה בינונית עד חמורה. מחקר CLEAR הוא המחקר השני שבו נערכה השוואה ישירה בין קוסנטיקס לתרופה אחרת. במחקר FIXTURE הוכחה גם עליונותה של קוסנטיקס על אנברל*** (אתנרספט) מבחינת ניקוי העור. פרופיל הבטיחות הכולל שהתקבל מתוכנית הניסויים הקליניים משלב III של קוסנטיקס היה מעודד, עם הבדלים מינימליים בינו לבין פרופילי הבטיחות של אתאנרספט ושל אוסטקינומאב בהשוואות הישירות5, 6.
בנוסף לאישורה באירופה, אושרה קוסנטיקס גם באוסטרליה לטיפול בפסוריאזיס רובדית בדרגה בינונית עד חמורה, וביפן לטיפול בפסוריאזיס רובדית בדרגה בינונית עד חמורה ובדלקת מפרקים פסוריאטית פעילה (PsA).
מנהל המזון והתרופות האמריקאי (FDA) צפוי לתת את החלטתו לגבי פסוריאזיס רובדית בדרגה בינונית עד חמורה בתחילת שנת 2015, בעקבות ההמלצה לאישור שניתנה פה אחד מהוועדה המייעצת בנושאי תרופות דרמטולוגיות ואופתלמולוגיות (DODAC) באוקטובר 2014.
קוסנטיקס (סקוקינומאב) ואינטרלוקין 17A (IL-17A)
קוסנטיקס היא נוגדן חד שבטי אנושי הנקשר באופן בררני לאינטרלוקין 17A (IL-17A) ומנטרל את פעילותו12, 13. IL-17A נמצא בריכוז גבוה בעור הנגוע בפסוריאזיס וזוהי מולקולת מטרה מועדפת לטיפולים ניסיוניים נגד המחלה1217. קוסנטיקס פועלת באמצעות עיכוב הפעילות של אינטרלוקין 17A (IL-17A), חלבון הנמצא בריכוז גבוה בעור הנגוע במחלה1217. בתוכנית הניסויים שלב III התקבל פרופיל בטיחות מעודד עם היקרות (incidence) דומה של תופעות לוואי חמורות בזרועות הטיפול השונות של סקוקינומאב (300 מ”ג ו-150 מ”ג)5, 1820.
כיום נמצאים בעיצומם מחקרי שלב IIIb על הטיפול בפסוריאזיס בכפות הידיים והרגליים (palmo-plantar), בפסוריאזיס בציפורניים ובפוסטולוזיס (pustulosis) בכפות הידיים והרגליים.
בנוסף לכך, קוסנטיקס נמצאת בשלב III בתוכנית הפיתוח לטיפול בדלקת מפרקים פסוריאטית (PsA) ובדלקת חוליות מקשחת (AS); ההגשות לאישור למצבים אלה מתוכננות לשנת 2015.
מקורות
1. Mohanan S, Ramassamy S, Chandrashekar L et al. A retrospective analysis of combination methotrexatecyclosporine therapy in moderatesevere psoriasis. Journal of Dermatological Treatment, 2014; 25: 5053. 2. European Medicines agency website, Enbrel Summary of Product Characteristics http://www.ema.europa.eu/docs/en_GB/document_library/EPAR__Product_Information/human/000262/WC500027361.pdf. Accessed November 2014. 3. European Medicines agency website, Humira Summary of Product Characteristics http://www.ema.europa.eu/docs/en_GB/document_library/EPAR__Product_Information/human/000481/WC500050870.pdf. Accessed November 2014. 4. European Medicines agency website, Stelara Summary of Product Characteristics http://www.ema.europa.eu/docs/en_GB/document_library/EPAR__Product_Information/human/000958/WC500058513.pdf. Accessed November 2014. 5. Novartis, Data on file. 6. Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in plaque psoriasis: results of two phase three trials. N Engl J Med. 2014. Jul 9;371(4):326-38. 7. Stern RS, Nijsten T, Feldman S, et al. Psoriasis Is Common, Carries a Substantial Burden Even When Not Extensive, and Is Associated with Widespread Treatment Dissatisfaction. J Investig Dermatol Symp. 2004;9(2):136-9.Nestle FO, Kaplan DH, Barker J. Psoriasis. N Engl J Med. 2009; 361(5):496-509. 8. Christophers E, Griffiths CEM, Gaitanis G, et al. The unmet treatment need for moderate to severe psoriasis: results of a survey and chart review. J Eur Acad Dermatol Venereol. 2006;20:921-925. 9. Krueger JG, Koo J, Lebwohl M, et al. The impact of psoriasis on quality of life: Results for a 1998 National Psoriasis Foundation patient membership survey. Arch Derm. 2001;137:280-284. 10. Sterry W, Barker J, Boehncke WH, et al. Biological therapies in the systemic management of psoriasis: International Consensus Conference. Br J Dermatol. 2004;151 Suppl 69:3-17. 11. McLeod LD, Mallya UG, Fox T, Strober BE. Psoriasis Patients With PASI 90 Response Achieve Greater Health-Related Quality-of-Life Improvements Than Those With PASI 75 Response. European Association of Dermatology and Venereology, Amsterdam, Netherlands, 2014. Poster 1681. 12. Gaffen SL. Structure and signaling in the IL-17 receptor family. Nat Rev Immunol. 2009;9(8):556-67. 13. Ivanov S, Linden A. Interleukin-17 as a drug target in human disease. Trends Pharmacol Sci. 2009;30(2):95-103. 14. Kopf M, Bachmann MF, Marsland BJ. Averting inflammation by targeting the cytokine environment. Nat Rev Drug Discov. 2010; 9(9):703-18. 15. Onishi RM, Gaffen SL. Interleukin-17 and its target genes: mechanisms of interleukin-17 function in disease. Immunology. 2010;129(3):311-21. 16. Krueger J, Fretzin S, Suárez-Fariñas M, et al. IL-17A is essential for cell activation and inflammatory gene circuits in subjects with psoriasis. J Allergy Clin Immunol. 2012;130(1):145-154. 17. Johansen C, Usher PA, Kjellerup RB, et al. Characterization of the interleukin-17 isoforms and receptors in lesional psoriatic skin. Brit J Dermatol. 2009;160(2):319-24. 18. Blauvelt A, Prinz J, Gottlieb AB, et al. Secukinumab Administration by Pre-filled Syringe: Efficacy, Safety, and Usability Results from a Randomized Controlled Trial in Psoriasis (FEATURE). Br J Dermatol. 2014; [published online ahead of print August 16, 2014]. 19. Paul C, Lacour JP, Tedremets L, et al. Efficacy, safety, and usability of secukinumab administration by autoinjector/pen in psoriasis: a randomized, controlled trial (JUNCTURE). J Eur Acad Dermatol Venereol. 2014; [published online ahead of print September 22, 2014]. 20. Novartis data on file. 2013: Clinical study reports for CAIN457A2302 [ERASURE] ; CAIN457A2303 [FIXTURE] ; CAIN457A2304 [SCULPTURE] ; CAIN457A2307 [JUNCTURE] ; CAIN457A2308 [FEATURE]. 21. Rapp SR, Feldman SR, Exum ML, Fleischer AB, Jr., Reboussin DM. Psoriasis causes as much disability as other major medical diseases. J Am Acad Dermatol. 1999; 41(3 Pt 1):401-7. 22. Farley E et al. Psoriasis: comorbidities and associations. G Ital Dermatol Venereol. 2011 Feb;146(1):9-15. 23. International Federation of Psoriasis Associations (IFPA) World Psoriasis Day website. About Psoriasis. http://www.worldpsoriasisday.com/web/page.aspx?refid=114. Accessed February 2014. 24. European Federation of Pharmaceutical Industries and Associations (EFPIA) website. Psoriais. http://www.efpia.eu/diseases/134/59/Psoriasis. Accessed September 2014.











השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!