הודעת חברת ניאופרם
רשות המזון והתרופות האמריקאי (FDA) אישרה לשימוש את Apremilast (Otezla®) , לטיפול בחולים עם פלאק פסוריאזיס ע”פ ההתויה הבאה (plaque psoriasis) :
For the treatment of patients with moderate to severe plaque psoriasis for whom phototherapy or systemic therapy is appropriate.
Apremilast (Otezla®) הינו מעכב של phosphodiesterase 4(PDE4) הניתן בכדור לבליעה. זהו הטיפול היחיד והראשון מסוגו, המשתמש במולקולה קטנה הפועלת במנגנון פעולה סלקטיבי, שאושר לטיפול בפלאק פסוריאזיס.
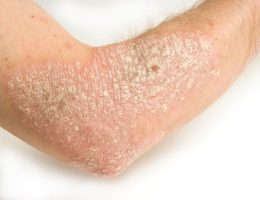
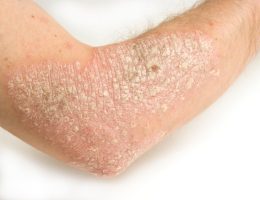
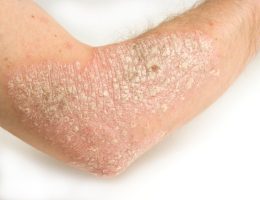
פסוריאזיס, מחלה כרונית דלקתית של העור הפורצת כתוצאה מתגובה חיסונית בלתי מבוקרת, משפיעה על כ- 150,000-200,000 אנשים בישראל.
אישור Apremilast (Otezla®) מתבסס בעיקר על תוצאות בטיחות ויעילות של שני מחקרים רב מרכזיים, מבוקרי פלצבו אקראיים וכפולי סמיות 1ESTEEM ו- 2ESTEEM – שנערך בחולים בוגרים הסובלים מפלאק פסוריאזיס בינוני עד חמור.
תוצאות המחקרים הדגימו כי הטיפול ב- Apremilast (Otezla®) הביא לשיפור משמעותי ובעל משמעות קלינית בפלאק פסוריאזיס, כפי שנמדד על ידי ציוני PASI. כ-59% מהחולים בעלי נגעים דיווחו על עור נקי בשיעור של 50% וכ-33% אחוז מהחולים דיווחו על הטבה בשיעור של 75%, בשבוע 16. זאת לעומת דיווח על שיפור בקרב כ-18% בלבד בקרב החולים בקבוצת הביקורת. הבטיחות של OTEZLA הוערכה ב- 1,426 חולים בשלושה ניסויים קליניים. תופעות לוואי העיקריות של Apremilast (Otezla®) היו שלשול, בחילות, דלקת בדרכי נשימה עליונה, כאב ראש מהמתח, וכאב הראש.
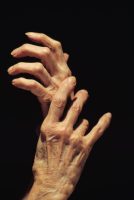
ב-21 למרץ 2014, אישר ה- FDAלשימוש את Apremilast (Otezla®) גם לטיפול בדלקת מפרקים פסוריאטית פעילה (Psoriatic Arthritis Active).
חברת ניאופרם הגישה את התכשיר Apremilast (Otezla®) , להכללה בסל ב-2015 להתוויות פלאק פוסריאיזיס ולדלקת מפרקים פסוריאטית.












השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!