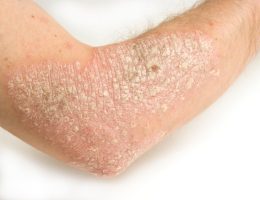
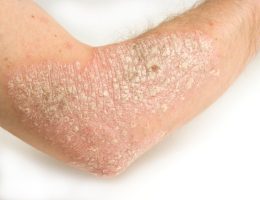
ועידת מייעצת מטעם מנהל המזון והתרופות האמריקאי הצביעה פה-אחד להמלצה לאישור תרופה ראשונה מסוגה לטיפול בפסוריאזיס רובדית בדרגה בינונית-עד-חמורה, במבוגרים המועמדים לטיפול ביולוגי או פוטותרפיה.
הועידה הצביעה ברוב של 7 תומכים לעומת 0 מתנגדים לאישור Secukinumab, נוגדן חד-שבטי הומאני מלא, המעכב ציטוקין פרו-דלקתי Interleukin-17A. תרופות ביולוגיות אחרות אושרו בעבר לטיפול במחלה ומצויות בשימוש, אך הן פועלות במנגנונים אחרים.
נוברטיס הגישה את תוצאות מחקרים בשלב 2 שכללו 660 חולים וארבעה מחקרים בשלב 3 שכללו למעלה מ-5,000 חולים. לאחר שהמחקרים בשלב 2 ביססו את המינון ומשטר הטיפול הרצוי, חוקרים בחנו שני מינונים שונים 150 ו-300 מ”ג במחקרים בשלב 3, בהשוואה לפלסבו בשלושה מחקרים ובהשוואה לEtanercept במחקר אחד.
המחקרים בשלב 3 הדגימו באופן עקבי כי Secukinumab הינו טיפול יעיל קלינית, עם שיפור משמעותי בתוצאות הטיפול בחולים.
מחברת התרופות נמסר כי Secukinumab במינון 300 מ”ג הביא לשיפור גדול יותר בהשוואה לטיפול במינון 150 מ”ג.
אעפ”י שאנשי ה-FDA הסכימו לרוב עם תוצאות היעילות שהציגה חברת התרופות, הם הציגו מספר שאלות בנוגע למינון הטיפול, סוגיה שעוררה דיון נרחב ע”י חברי הפאנל. לדברי מומחי ה-FDA, מניתוח לפי תתי-קבוצות עלה שיעור גבוה יותר של זיהומי קנדידה בעור וריריות, בפרט עם טיפול במינון 300 מ”ג, עדות לקשר חשיפה-תגובה וקשר מנה-תגובה עם זיהומי קנדידה, אם כי שיעור הזיהומים בכללותו היה נמוך. הנתונים הקצרי-טווח יחסית שכללו ממצאים במשך כשלוש שנים הציגו תמונה לא-ברורה של ההשפעה האפשרית של התרופות לדיכוי חיסוני על מחלות אוטואימוניות, כולל ממאירויות מסוימות.
עם זאת, מהנתונים עלה כי היעילות של Secukinumab גדלה עם העלאת המינון ואנשי מנהל המזון והתרופות האמריקאי הציגו לחברי הפאנל שאלה אם יש להשלים מחקר לאחר-שיווק להערכת טיפול במינון 450 מ”ג.
לסיכום, ייתכן כי הטיפול במינון גבוה יותר עדיף בחולים בעלי משקל גדול יותר (90 קילוגרמים ומעלה) שאינם מגיבים או מגיבים לאט לטיפול במינון 300 מ”ג, בעוד שמינון של 150 מ”ג עשוי להספיק בחולים השוקלים פחות מ-90 קילוגרמים. במילים אחרות, המינון הנמוך עשוי להיות בטוח יותר, אך המינון הגבוה יעיל יותר בכללותו.
מתוך הודעת ועידה מייעצת ל-FDA
















השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!