סקירת עורך מדור הנפרולוגיה ד”ר שוקי וייסגרטן ושות’
ז’ורגן סכנרמן (מכון לאומי של סוכרת, מחלות מערכת העיכול וכליות; בטזדה, מרילנד) פרסם סקירה מאוד מעניינת תחת הכותרת הנ”ל בעיתון JASN מיוני 2003 (1681-1694). המחבר הקדיש את הרצאתו לזכרו של הומר סמיט (נפרולוג שעסק בתחום הפיזיולוגיה כלייתית (בשנות 1920-1961, דנבר), בעל יותר מ- 100 עבודות אוריגינליות בנושאים שונים חשובים, כגון: מתודולוגיה למדידת GFR ו- RBF, פינוי מים חופשיים (Free Water Clearance) ודילול שתן כתוצאת ספיגת NaCl דרך ממברנה אשר אינה חדירה למים (בנפרון הדיסטלי); גילוי של urea back-diffusion כתורם לפינוי הנמוך שלו ותלותו בזרימת השתן וכ”ו; הומר סמיט נפטר ב- 1962).
הסקירה מתחילה עם תיאור ה Juxta-Glomerular Apparatus – JGA : הוא כולל תאי אפיטליום, מזנגיום ותאים וסקולריים ונוצר כתוצאה ממגע של Thick Ascending Limb) TAL) עם העורקיק האפרנטי (afferent arteriole). למעשה תאי אפיטל מיוחדים של Macula Densa (MD) באים במגע עם תאים מזנגיאליים ובאמצעותם עם תאי שריר חלקים וסקולריים ותאים גרנולריים היוצרים רנין (בעורקיקים גלומרולריים).
היום ידוע שהמבנה הזה משרת שני תפקידים חשובים בגוף (ושניהם קשורים להומאוסטזיס של נתרן): הראשון – Tubulo-Glomerular Feedback (TGF) והשני – יצור והפרשת רנין מבוקרת ע”י NaCl.
אף על פי ששתי המערכות מורכבות מאותם המשתתפים, הן שונות על פי המאפיינים.
תגובת הטונוס הוסקולרי לגירוי מ- MD (גם שפעול וגם דיכוי) די מהירה: מ- 20 עד 60 שניות. לעומת זאת שליטת MD על הפרשת רנין הנה תהליך יותר איטית (עד 5 דקות), מגיבה בעיקר לשינויי נפח חוץ תאי (extracellular volume) ופועלת לטווח ארוך יותר לוויסות מלחים בגוף דרך הפרשת אנגיוטנזין II.
העבודות הניסוייות על TGF החלו מאז הופעת שיטת ה-microinjection שהמוצאה ע”י Thurau ו- Schnermann (JASN, 1965): לאחר הפרדת סגמנט פרוקסימלי דקרו את הטובול הדיסטלי של אותו נפרון והזריקו לשם נוזלים. כאשר הזריקו תמיסות איזוטוניות (של NaCl או NaBr) – הטובול הפרוקסימלי התמוטט לגמרי (completely collapsed) והדבר פורש כירידה קשה של GFR.
בהמשך, עבודות חדשניות יותר הראו שהפסקת GFR היא לא ‘סתם’ תגובה אופיינית לריכוז דיסטלי של NaCl , ונעשה ניסיון להעריך TGF בדרך יותר כמותית (J. Schnermann et al, 1970): אחרי זיהוי של הטובול הפרוקסימלי ע”י הזרקת דיו, ביצעו הזרקת-מיקרו בלולאות ההנלה מסגמנט הפרוקסימלי השטחי האחרון.
הזרימה ב- upstream segment הופסקה ע”י הזרקת חסימה לא ניידת (immobile block) ונאספו נוזלים מייד אחרי ה- upstream segment למדידת GFR, ובטובול הדיסטלי למדידת ריכוזי Na ו- Cl.
תוצאות הניסויים האלה הדגימו שקצב הזליפה עולה ביחד עם עלית ריכוז הנתרן ובמקביל יורד ה- GFR של הנפרון המבודד (Single Nephron GFR – SNGFR).
ירידת SNGFR לא נצפתה כאשר במקום NaCl הזריקו החוקרים תמיסה איזוטונית של מניטול או Na Sulfate.
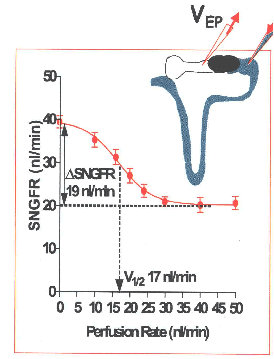
בהמשך הייתה עבודה מעניינת שבה בשיטה הנ”ל ביצעו 9 מדידות שונות של GFR עם 9 מהירויות זרימה שונות וגילו יחס סיגמוידלי (sigmoidal relationship) בין SNGFR ובין מהירות הזרימה בחלק הסופי של הנפרון הפרוקסימלי (end-proximal flow rate).
הודגם ש- SNGFR יורד ב- 50% כתוצאה מעלית מהירות זרימה בטובול הפרוקסימלי בטווח הפיזיולוגי של הזרימה הפרוקסימלית (מ- JP. Briggs et al, 1984).
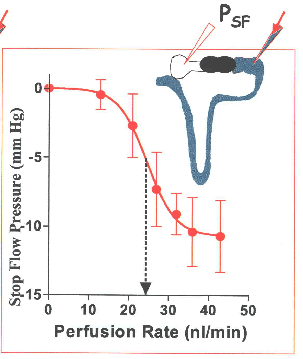
כחלופי לשיטה הנ”ל, נמדד לחץ עצירת זרימה (stop flow pressure ) באזור קרוב יותר לגלומרולוס בטכניקה פשוטה יותר במקום SNGFR, כאשר הלחץ הנ”ל נמצא בקורלאציה ישירה ל- glomerular capillary pressure (Schnermann et al, 1973); stop flow pressure הדגים אותו יחס סיגמוידלי עם מהירות הזליפה:
ובכן, המאפיין החשוב ביותר של TGF הוא נטייה להשתנות ביחס למהירות הזרימה (גבוהה או נמוכה) ולשנות את הרגישות שלו ע”י ירידה או עליה בשיפוע (slope) של תפקודו. סטייה שמאלה מתרחשת למשל ב- volume depletion וכל מצב אחר אשר מלווה ברמה גבוהה של אנגיוטנזין II, כאשר סטייה ימינה מאפיינת בעיקר רמות נמוכות של אנגיוטנזין II ורמות גבוהות של Nitric Oxide (ב- volume expansion למשל).
לסיכום, מערכת TGF מדגימה יחס הפוך וסיגמוידלי בין SNGFR ובין מהירות הזרימה בטובול הפרוקסימלי. נקודת שפעול (operating point) שלו נמצא באמצע טווח פעולתו, כאשר יכולת הפיצוי האופטימלית לטעות (optimal error compensation) נמצאת מסביב לנקודת השפעול, והיא עשויה לשנות את טווח השפעול והרגישות שלו בתגובה לשינויים.
בויסות של הטונוס הוסקולרי והפרשת רנין מעורבים תאים שונים של JGA : גירוי מסוים בלומן (lumen) טובולרי נקלט ע”י תאי אפיטליום ב- MD, משם דרך האינטרסטיציום של ה- JGA מגיע לשני end-points : התכווצות שרירית והפרשת רנין.
על מנת לתאר את הפיזיולוגיה של הגירוי הלומינלי האחראי על ה- TGF שבהמשך הופך ל- end-point וסקולרי, השתמשו בטכניקה חדשנית המאפשרת להזליף תמיסות שונות באזור קרוב מאוד ל- MD, כך שבטובול בדרך ל- MD התמיסות לא משתנות (J. Schnermann et al, 1976). תמיסות של Na מעוררות תגובה מלאה בתנאי של זליפה קבועה.
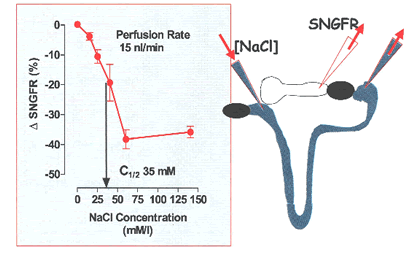
הריכוז הגורם לירידת SNGFR חצי-מקסימלית היה בערך 35 mM/l, שקרוב לוודאי זהו הריכוז הרגיל באזור של MD. וכאשר השתמשו בטכניקת retrograde perfusion תגובה דומה נצפתה אפילו אם Na בתמיסה החליפו ע”י קטיונים אוניוולנטיים אחרים (univalent cations), אך ללא תגובה אם הוחלף Cl ע”י מספר אניונים (למעט ה- Br). המסקנה היא שריכוז Cl הנו אחראי על תגובת TGF, כאשר שינויים ב- Na או אוסמולריות לא הכרח.
הפרשת רנין אשר תלויה ב- MD נחקרה בעבודות in vivo ע”י AJ Vander (1967), והושלמה בהמשך ע”י Skott and Briggs (1987) ע”י עבודות in vitro ; החוקרים פיתחו טכניקה מיוחדת שמאפשרת מדידות רנין: הם הפרידו את TAL עם הגלומרולוס שלו מכלית ארנב ובטכניקת Burg ע”י פיפטה הזליפו תמיסה דרך ה- ascending limb.
הדגימה נדבקה ל- perfusion pipette והוכנסה לפיפטה חיצונית מזכוכית שתפקדה כ- superfusion chamber. לאחר הזרמה בדגימת TAL, את כל המערכת הטבילו בשמן צמחי.
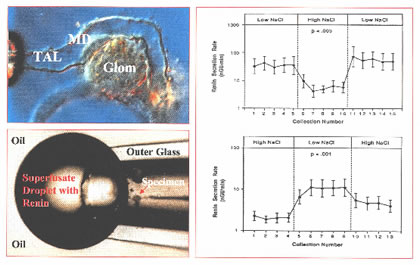
ה- superfusate מכיל רנין ששוחרר בצורת טיפות אשר ניתן למדדו בהן. הגירוי הלומינלי להפרשת רנין תלוי בשינויים בריכוז Cl. ריכוז ה- Cl הגורם לתגובה חצי-מקסימלית הנו בערך 25-30 mM/l. גם כאן החלפת Na ע”י קטיון אחר אינה משנה את התגובה, כאשר החלפת Cl כן משנה.
ידוע שמשתנים כ- furosemide או bumetanide (loop diuretics) חוסמים לגמרי את ה- TGF ומפעילים הפרשת רנין. במספר עבודות הוכיחו כי שינויים בהובלת NaCl דרך מובילים (transporters) אפיטליאליים (ובמיוחד, דרך NKCC2 או ROMK) מהווה למעשה ארוע אפיטליאלי ראשוני ב- MD ב- pathway של TGF (JN Lorenz et al, 2002; J Schnermann et al, 1995).
עד היום לא ברור האם השינויים בתאי אפיטליום התלויים בפעילות מוגברת של NKCC2 הם חלק מ- JGA pathway או לא. שפעול של NaCl cotransport גורם לעלית ריכוז Na ו- K בציטוזול (cytosol) וכמו כן לעלית ריכוז Cl בציטוזול, דפולריזצית תאים, ויתכן גם לעלית ריכוז סידן בציטוזול, נפיחות ואלקליניזציה של התאים.
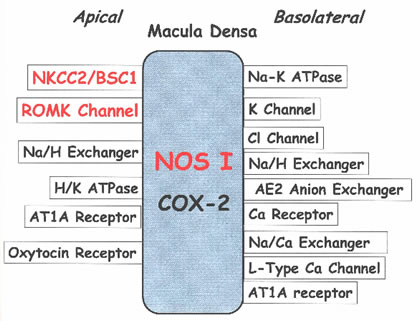
פרט לכך לא לגמרי ברור האם מספר רב של המובילים האפיטליאליים אשר התגלו לאחרונה בממברנה האפיקלית או הבזולטרלית של ה- MD משחקים תפקיד כלשהו ב- JGA pathway. נכון להיום פרט ל- NKCC2 או ROMK אף מוביל לא הוכח בתור משתתף בתהליך TGF או renin pathway. רוב החלבונים האפיטליאליים האחרים (קולטנים לאנגיוטנזין II, NHE, H/K ATPase וכ”ו) מהווים מרכיבי תגובה וסקולרית.
הפרק הבא של הסקירה דן במנגנונים המתווכים בין MD ובין התאים האפקטוריים (effector cells). בתהליך TGF חשובה מעורבות של אדנוזין ו- Adenosin 1 Receptors (A1AR) : קיימות הוכחות לכך על פי ניסויים פרמקולוגיים גם in vitro וגם in vivo. למשל, A1AR knockout mice אינם מפתחים TGF (R Brown et al, 2001). ועלית ריכוז NaCl בתוך ה- lumen גורמת ליצור של אדנוזין.
באינטרסטיציום של JGA והאדנוזין שמתחבר לקולטן A1AR גורם ל- vasoconstriction במסגרת TGF. אדנוזין נוצר בתוך או מחוץ לתאי MD בתהליך פירוק של ATP.
מבחינת הפרשת רנין היה מעניין האם הפרשת אדנוזין ושפעול של A1AR תורמים גם לויסות רנין בגוף. עבודות ניסוייות שונות הראו שדיכוי הפרשת אדנוזין ע”י ריכוז נמוך של NaCl ב- A1AR knockout mice לא משבש הפרשת רנין.
מצד שני, הופיעו עבודות המוכיחות מעורבות של פרוסטגלנדינים בהפרשת רנין דרך השפעה על MD (SG Greenberg et al, 1993; V. Valon et al, 1997 וכ”ו). באותן עבודות הוכח כי MD וגם כל הרקמה מסביב ל- TAL מכילים אך ורק COX-2.
הודגם ש- COX-2 specific inhibitors מדכאים הפרשת רנין בדגימת JGA של ארנב, כאשר Aspirin אינו גורם לאפקט דומה. מחבר הסקירה מאמין ש- prostaglandin-dependent pathway הוא אותו pathway אשר גורם לשפעול מערכת renin-angiotensin בחולי Bartter’s syndrome (המצב מתאפיין בהפרשת יתר של PGE2).
ובכן, ירידת ריכוז NaCl בתוך ה- lumen מפעילה את COX-2 שגורם להפרשת PGE2, והאחרון – לייצור והפרשת רנין. תגובה וסקולרית והפרשת רנין – שני התהליכים האלה נגרמים ע”י גירוי לומינלי אחד (ריכוז Cl), אבל על מנת לבצע את האפקט הסופי, משתמשים במתווכים חוץ תאיים לגמרי שונים.
באשר לתגובת תאים אפקטוריים (effector cells) ל- TGF, לא פחות מעניינת היא צורת התגובה של תאי שרירים חלקים וסקולריים לגירוי.
צייננו כי אדנוזין נחשב כמתווך בין תאי MD ובין תאים אפקטוריים בעורקיק אפרנטי (afferent arteriole) – החלק הקרוב לגלומרולוס שמגיב גם לאנגיוטנזין II. יתכן שבמקום זה קיים שיתוף פעולה מסוים בין אדנוזין לבין אנגיוטנזין II.
לבירור הנושא בוצעו מספר עבודות שהדגימו הפחתת תגובת TGF לאדנוזין אצל AT1 receptor- or ACE knockout mice או במיקרי טיפול ע”י ACE או ARBs. ולהפך – בזמן עלית ריכוז אנגיוטנזין II (למשל, הזרקת אנגיוטנזין II) מתחזקת התגובה לאדנוזין(J Schnermann et al, 1997; T Traynor et al, 1999).
כיצד מתקיים המנגנון של אינטראקציה בין אדנוזין ואנגיוטנזין – לא ברור עד היום.
סיכום
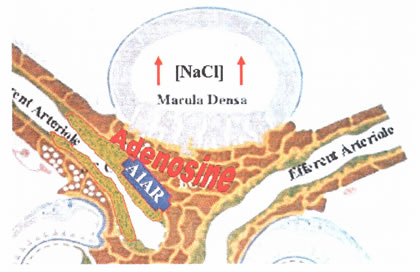
שינויים בריכוז NaCl ויתכן גם KCl ב- MD מהוה גירוי לשפעול תאי שריריים חלקיים וסקולריים או גרנולריים. עלית ריכוז NaCl מלווה בתגובה בתא אפיטליום הכוללת התנפחות התא הנגרמת ע”י NKCC2, דפולריזציה, ועלית ריכוז סידן בציטוזול.
באותו הזמן, אקטיבציה של NKCC2 גורמת לייצור של אדנוזין באינטרסטיציום של JGA ודיכוי של הפרשת PGE2.
אדנוזין מפעיל קולטני אדנוזין A1 בשרירים חלקיים וסקולריים ו/או תאי מזנגיום אקסטרהגלומרולרי, וזה גורם לשפעול של פוספוליפזה (התלויה בחלבון Gi), דפולריזציה , פתיחת תעלות סידן (אשר הן voltage-dependent) והתכווצות:
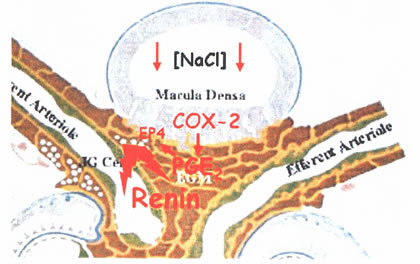
ולהפך: ירידת ריכוז NaCl לומינלי גורמת לתגובה אפיטליאלית שכוללת אקטיבציה של MAP kinases ופעילות של COX-2, ואינדוקצית COX-2. באינטרסטיציום של JGA מופיע PGE2 ואדנוזין מדוכא. PGE2 מפעיל קולטני EP4 (קולטן של פרוסטגלנדין) על התאים הגרנולריים אשר גורמים לשפעול של adenylate cyclase (ע”י החלבון המאזן GS) והפרשת רנין. במילים אחרות, שני מצבים הפוכים שבהם תאי MD משתתפים:
ולבסוף, סקירת הספרות שהצגנו מאפשרת להבין את התופעה המעניינת, כאשר תגובות פיזיולוגיות שונות (TGF או ייצור והפרשת רנין מבוקרת ע”י NaCl- אוטורגולציה) נגרמות ע”י גירוי משותף (ריכוז כלור ב- MD) בהתאם למצבים ההמודינמיים ספציפיים.
שני המנגנונים הנ”ל חשובים למניעת איבוד יתר מלחים ומים חופשיים מהגוף.

















השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!