גרסאות ביוסמיליאריות של התרופה הנמכרת ביותר בעולם, Humira של חברת אבוי (adalimumab), אושרו לשיווק באירופה השבוע, וזאת מספר שנים לפני שאישורים דומים יהיו זמינים גם בארצות הברית.
חברת אמגן השיקה את הגירסה הביוסימילרית של יומירה, הממותגת בשם אמגביטה, ברחבי אירופה החל מה -16 באוקטובר, בעוד נוברטיס דיווחה כי חטיבת סנדוז שלה משיקה את הגירסה הביוסימילארית שלה, Hyrimoz בבריטניה, ובמספר שווקים אחרים.
מדובר על פוטנציאל שוק גדול ביותר, שכן יומירה נחשבת לתרופה עם היקף המכירות העולמיות הגדול בעולם, היקף של כ -18 מיליארד דולר בשנה שעברה, מתוכם כ -4 מיליארד דולר במכירות באירופה. ע”פ הדיווח, ומנהלי שירותי הבריאות באירופה מצפים לנצל את התחרות כדי לקצץ בתקציבי הטיפולים התרופתיים.
במערכת הבריאות בארה”ב, לעומת זאת, הגירסאות הביוסמיליאריות של יומירה לא צפויות להיות זמינות עד שנת 2023, וזאת בשל שורה של פטנטים המגנים על יומירה.
אנליסטים צופים לכן, שבשל כך, היקף המכירות הגלובליות של Humira ימשיך לצמוח במשך ארבע השנים הקרובות, למרות הירידה הצפויה כעת באירופה.
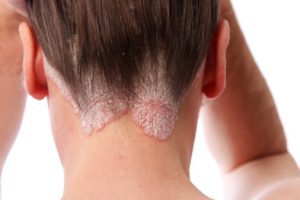
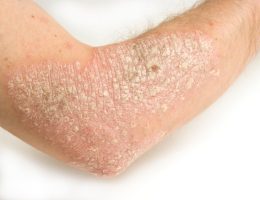
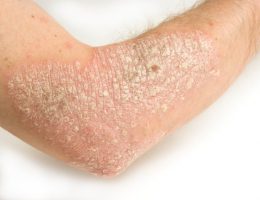
כידוע, Humira, משמשת לטיפול בדלקת מפרקים שגרונית, מחלת קרוהן, קוליטיס כיבית ופסוריאזיס, ועל כן היא מהווה גם פוטנציאל גדול לחיסכון בעלויות שירותי בריאות, וגם את היעד מספר אחד של חברות הביוסמיליאר.
ע”פ הדיווח במדסקייפ, שתי גירסאות ביומסימילריות נוספות של התרופה צפויות להיכנס לשוק בקרוב על ידי Mylan ו- Samsung Biopis של סאות ‘קוריאה. גירסה ביוסמיליארית חמישית מתוצרת בורינגר אינגלהיים הגרמנית שתוכננה להיות משווקת באירופה, מוקפאת עדיין בשל התדיינות משפטית בנושא פטנטים.
כידוע, Biosimilars הם עותקים כמעט מושלמים של תרופות ביולוגיות מקוריות, אך אינם זהים לחלוטין בשל המרכיב הביולוגי בתרופת המקור. כתוצאה מכך, נדרשת על ידי הרשויות בדיקה מקיפה יותר בהשוואה לבדיקות הנעשות בתרופות גנרית כימיות, מה שגורם לכך שעלויות הפיתוח של הביוסמיליאר גבוהות יותר בהשוואה לפיתוח תרופה גנרית.
נכון להיום, אמגן ונוברטיס אינן חושפות עדיין את המחיר שהן יציעו את תכשיריהן , אך נציג של אמגן אמר ששיווק התכשיר צפוי להשיג חיסכון בעלויות עבור החולים, בתי חולים ומערכות הבריאות.
בכתבה במדסקייפ מצוייו כי הקצב של שימוש בתרופות ביוסימילריות עשוי להשתנות ממדינה למדינה בכל רחבי אירופה, כפי שקרה עם תרופות ביוסמיליאריות ל- Remicade (infliximab) ו- Enbrel (etanercept) שתי מתחרות של Humira ולתרופה לסרטן הדם Rituxan / MabThera.
המדינות המובילות באימוץ מוקדם של שימוש בביוסימילאר הן המדינות הסקנדיביות ואנגליה. באנגליה אף נקבע יעד של השגת שיעור שימוש של 90% מהחולים החדשים בתרופות ביוסימילאריות בתוך שלושה חודשים מהכנסת ביוסמיליאר לשוק ושל 80% שימוש בקרב ההחולים הקיימים בתוך 12 חודשים.
ע”פ הדיווח, במקרה של Humira, רשויות הבריאות בבריטניה הנחו את מנהלי הרכש במוסדות הבריאות שלא לחתום על הסכמי רכש חדשים של הומירה, מעבר ל -16 באוקטובר – תאריך התפוגה של הפטנט האירופי העיקרי של יומירה.
הערת המערכת: מתוך שיחות שקיימנו עם מס’ גורמים בתחום נראה שלמרות מבנה השוק הריכוזי של קופות החולים, העשוי לאפשר בקלות רבה יותר מדיניות אימוץ מוקדם ומהיר של שימוש בביוסימילאר, השימוש בתרופות הביוסמילאריות הרשומות בארץ הוא עדיין מוגבל יחסית.














השאירו תגובה
רוצה להצטרף לדיון?תרגישו חופשי לתרום!